اخذ گواهینامه ایزو 13485
پیش از اقدام به اخذ گواهینامه ایزو 13485 لازم است با برخی مفاهیم ابتدایی و پایه آشنا شویم.

هدف ISO 13485 چیست؟
پذیرش ایزو 13485 پایه و اساس عملی را برای تولیدکنندگان فراهم می کند تا دستورالعمل تجهیزات پزشکی اتحادیه اروپا (MDD)، مقررات تجهیزات پزشکی اتحادیه اروپا (MDR) و سایر مقررات را مورد توجه قرار دهند و همچنین تعهد به ایمنی و کیفیت تجهیزات پزشکی را نشان دهند.
با شروع با پشتیبانی مدیریت و شناسایی الزامات مشتری برای QMS، باید شروع به توسعه مستندات از جمله خط مشی کیفیت، اهداف کیفیت و کتابچه راهنمای کیفیت کنید. اینها با هم، دامنه کلی و اجرای سیستم مدیریت کیفیت را تعریف می کنند. در کنار این موارد، شما باید فرآیندها و رویههای اجباری و اضافی لازم را برای سازمان خود ایجاد کنید تا محصول یا خدمات خود را به درستی ایجاد و ارائه کند.
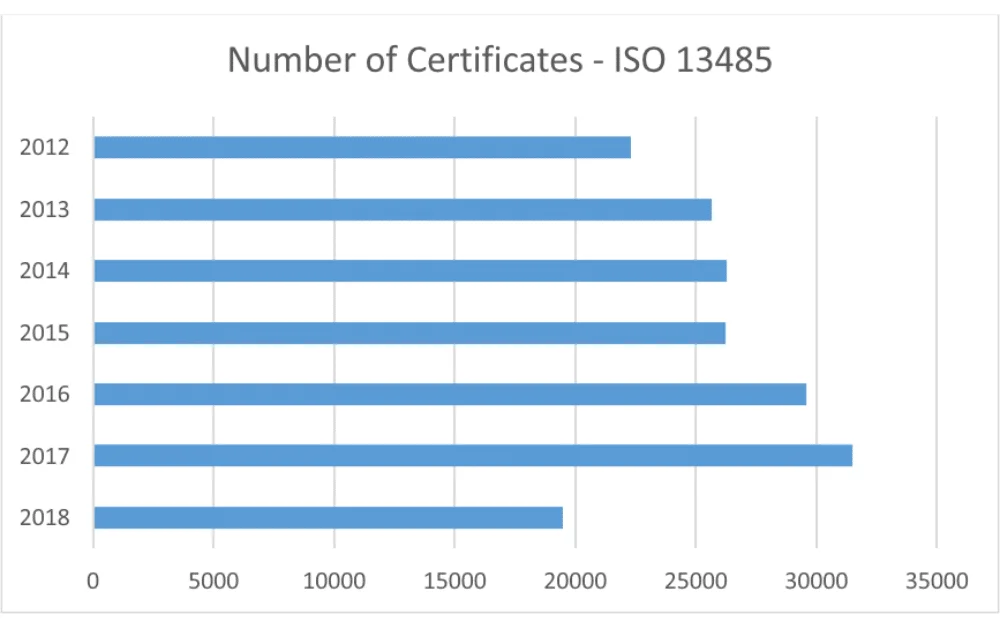
برای توضیح خوب در این مورد، نگاهی به مقاله فهرست اسناد اجباری مورد نیاز ISO 13485:2016 بیندازید. بررسی شرکتهای دارای گواهینامه ایزو 13485 نشان میدهد که تعداد شرکتهایی که سیستم مدیریت کیفیت ایزو 13485 را پیادهسازی کردهاند، همچنان روند مثبت کلی را در سراسر جهان نشان میدهد.
نسخه فعلی ایزو 13485 چیست؟
آخرین ویرایش ISO 13485 برای دستگاه های پزشکی از مارس 2016 است. از جمله موارد اضافه شده به این به روز رسانی عبارتند از: تمرکز بر ریسک، شفاف سازی مسئولیت های مدیریتی، شفاف سازی مسئولیت های آموزشی، بهبود نیازمندی های تسهیلات، همسویی بهتر طراحی و الزامات توسعه برای بسیاری از مقررات، تاکید بیشتر بر کنترل تامین کنندگان، الزامات رویه های ردیابی، اضافه شدن رسیدگی به شکایات، و افزایش الزامات پاکیزگی محصول. همه تغییرات را در اینجا مشاهده کنید: اینفوگرافیک: موارد جدید در بازبینی ISO 13485 در سال 2016.
استاندارد ISO 13485:2016 با نسخه قبلی ISO 9001، ISO 9001:2008 مطابقت دارد. ISO 9001 یک استاندارد بین المللی شناخته شده برای سیستم های مدیریت کیفیت (QMS) است که توسط ISO (سازمان بین المللی استانداردسازی) منتشر شده است.
الزامات آن در سراسر جهان به عنوان مبنای قابل قبولی برای اجرای QMS شناخته شده است. اگرچه استاندارد ISO 13485:2016 پس از به روز رسانی اصلی ISO 9001:2015 منتشر شد، استاندارد ISO 13485 با این تجدید نظر جدید ISO 9001 مطابقت ندارد. در عوض، مشخص شد که آخرین تغییرات در ISO 9001:2015 بوده است. برای وسایل پزشکی ضروری نیست.
مطلب پیشنهادی: اخذ گواهینامه ایزو 9001
الزامات ISO 13485 چیست؟
ISO 13485:2016 الزامات یک سیستم مدیریت کیفیت را برای تولید دستگاه های پزشکی ISO و خدمات مرتبط که به طور مداوم الزامات نظارتی مشتری و قابل اجرا را برآورده می کند، مشخص می کند. الزامات ISO 13485:2016 برای سازمان ها صرف نظر از اندازه و بدون توجه به نوع آنها قابل اعمال است، مگر در مواردی که به صراحت ذکر شده باشد.
هر جا که الزامات مربوط به تجهیزات پزشکی مشخص شده باشد، الزامات به طور یکسان برای خدمات مرتبط ارائه شده توسط سازمان اعمال می شود. ساختار ایزو 13485 به هشت بخش تقسیم می شود که سه بخش اول مقدماتی و پنج بخش آخر شامل الزامات اجباری برای سیستم مدیریت کیفیت است.
در اینجا پنج بخش اصلی در مورد آن است: بند 4 – سیستم مدیریت کیفیت (“تقاطع”) بند 4 دو جنبه بسیار خاص از یک سیستم مدیریت کیفیت را هدف قرار می دهد: الزامات عمومی و الزامات مستندسازی. الزامات کلی. در ارزیابی هر استاندارد ISO، چند الزام سیستماتیک وجود دارد که نیروی محرکه برای استقرار و پیاده سازی یک سیستم مدیریت کیفیت است. الزامات ویژه ایزو 13485 شامل موارد زیر است:
- استاندارد را رعایت کنید.
- آنچه را که باید مستند شود مستند کنید.
- آنچه از شما خواسته می شود را حفظ کنید.
- رویه های مکتوب داشته باشید و از اثربخشی سیستمی که پیاده سازی می کنید اطمینان حاصل کنید.
- عوامل خطر را در همه فعالیت ها در نظر بگیرید.
- اقداماتی را برای به حداقل رساندن خطرات شناسایی شده و با هدف عدم ایجاد حوادث فاجعه آمیز معرفی کنید.
- شناسایی کنید که برای تولید دستگاه پزشکی شما چگونه باید انجام شود و به آن فرآیندها پایبند باشید.
- راههایی را برای ردیابی فعالیتهای خود، تصحیح هرگونه شکست یا نادیده گرفتن فرآیند، و ایجاد سوابق برای نشان دادن تمام فعالیتها در حال انجام، تعیین کنید.
- الزاماتی را که از نظر قانونی به آنها ملزم هستید را تعیین کنید و آنها را دنبال کنید!
- حتی زمانی که کار را برون سپاری می کنید، مطمئن شوید که مسئولیت آن کار را حفظ می کنید.
- سیستمهایی که در فرآیندهای تولید شما استفاده میشوند باید تأیید شوند تا اطمینان حاصل شود که طبق برنامه کار میکنند و بر فرآیندهای شما تأثیر منفی نمیگذارند.
اکثر سیستم های کیفیت به یک جزء کلیدی نیاز دارند، کتابچه راهنمای کیفیت. فراتر از کتابچه راهنمای کیفیت، یک سازمان باید تعهدی را که برای اطمینان از محیط و فرهنگی که می تواند با اولویت دادن به کیفیت در همه فعالیت ها سازگار باشد، تعیین کند. این تعهد را می توان با یک سیاست یا بیانیه عینی دریافت کرد. این استاندارد شامل الزامات بسیار خاصی هم برای رویه ها و هم برای سوابق است که هر یک باید رعایت شوند:
ایجاد دستگاه پزشکی باید همراه با فایلی باشد که شامل مشخصات محصول و راهنمایی در مورد استفاده مورد نظر باشد.
برنامه ریزی برای کنترل اسناد
برنامه ریزی برای کنترل سوابق
بند 5 – مسئولیت مدیریت (“بزرگراه”) مدیریت باید تعهد خود را با نشان دادن اینکه می تواند در قبال عملیات درون سازمان خود پاسخگو باشد نشان دهد. آنها باید اطمینان حاصل کنند که تمرکز آنها از نیازهای کاربر نهایی منصرف نمی شود و تمام قوانین در فرآیند تولید رعایت می شود.
مدیریت مسئولیت مطلق حمایت از خط مشی کیفیت، تایید همسویی آن با قوانین کشور محل کار، و ابلاغ ماموریت به کارکنان را دارد. آنها مسئول برنامه ریزی، تفویض اختیار و برقراری ارتباط موثر هستند. آنها همچنین مسئول بررسی دوره ای عملیات و بهبود در سازمان هستند که به عنوان بررسی مدیریت شناخته می شود.
بند 6 – مدیریت منابع (“جاده”) مدیریت ارشد مسئولیت دارد اطمینان حاصل کند که سیستم مدیریت کیفیت با ایزو 13485 مطابقت دارد و الزامات مقررات محلی را رعایت می کند. به عنوان یک الزام در ISO 13485، مدیریت ارشد باید اطمینان حاصل کند که منابع کافی برای انجام کارهای وعده داده شده توسط سازمان در دسترس است. تامین منابع می تواند به پرسنل، زیرساخت ها، مواد مصرفی، تجهیزات، برنامه ریزی جانشین پروری و ریسک گریزی اشاره داشته باشد.
این می تواند به همان اندازه خاص باشد که گردش کار روزانه را کنترل کند تا از آلاینده ها جلوگیری شود یا اطمینان حاصل شود که عملیات در سال های آینده با آگاهی از بازنشستگی در آینده یکپارچه است. این تعهد از سوی مدیریت، اگرچه ممکن است حداقل به نظر برسد، اما برای موفقیت سازمان در تولید تجهیزات پزشکی حیاتی است و طبق بند 6 الزامی است. . این میتواند شامل ایجاد فرآیندی برای مستندسازی نحوه شروع افکار، تأیید مفاهیم، و طراحی و توسعه محصولات، و همچنین نحوه تأیید و اعتبار برای تحقق الزامات ISO 13485، بند 7 باشد.
ارتباطات برای طراحی و طراحی بسیار مهم است. توسعه دستگاه نکته کلیدی این است که فرآیند را از برنامه ریزی تا ورودی ها، خروجی ها تا بررسی، به بعد تا تأیید، و به دنبال آن تأیید از طریق اعتبار سنجی دنبال کنید. انتقال ایده ها، کنترل طرح، ثبت هرگونه تغییر مورد نیاز، و حفظ همه فایل های موجود در فرآیند در تحقق محصول بسیار مهم است. تعریف و ردیابی منابع، حفظ اطلاعات حیاتی مرتبط با هر محصول، و تعیین نحوه تأیید این محصولات باید به وضوح در یک رویه مستند شود.
نظارت بر هر بخش از فرآیند شامل حصول اطمینان از پاکیزگی، نظارت بر اقساط، انجام خدمات لازم و برآوردن الزامات خاص دستگاههای پزشکی است. نظارت و نگهداری موثر تجهیزات و همچنین اطمینان از برآورده شدن الزامات شناسایی برای خود دستگاه نیز از اجزای تحقق محصول است.
در نهایت، نظارت بر اثربخشی محصول در ارتباط با قابلیت ردیابی، مدیریت دارایی مشتری، و حصول اطمینان از حفظ محصول، به دستیابی به انطباق با ISO 13485 کمک میکند. تولید شده و برای استفاده عمومی منتشر شده است، شما به نوعی مسئولیت دارید که اطمینان حاصل کنید که مردم آنچه را که می خواهند دارند. بنابراین، چگونه آن را انجام می دهید؟ ساده است: شما به دنبال بازخورد هستید. طبق بند 8، توسعه روشی برای نظارت موثر و اندازه گیری موفقیت محصول باید شامل موارد زیر باشد:
- رسیدگی به شکایات
- گزارش رویدادها به مقامات نظارتی
- انجام ارزیابی های داخلی از طریق حسابرسی
- فرآیند مستمر و ارزیابی محصول در داخل
- شناسایی و کنترل محصولاتی که الزامات طراحی اصلی را برآورده نمی کنند (محصول ناسازگار)
- تجزیه و تحلیل داده های تولید شده و بهبود مستمر فرآیند
این بخش ها بر اساس یک چرخه Plan-Do-Check-Act هستند که از این عناصر برای اعمال تغییرات در فرآیندهای سازمان به منظور هدایت و حفظ پیشرفت ها در فرآیندها استفاده می کند. برای یادگیری نحوه اجرای الزامات ایزو 13485 و دریافت گواهی، این مقاله را بخوانید: گواهینامه ISO 13485.
تفاوت بین ISO 13485 و EN ISO 13485 چیست؟
همانطور که در بالا ذکر شد، ISO 13485 یک مجموعه استاندارد بین المللی شناخته شده از الزامات است که توسط سازمان بین المللی استاندارد (ISO) برای ایجاد یک سیستم مدیریت کیفیت برای کسانی که در صنعت تجهیزات پزشکی هستند، صادر شده است. استاندارد ISO شامل تمام الزامات مورد نیاز برای ایجاد یک QMS برای نشان دادن توانایی شما در ارائه تجهیزات پزشکی است که به طور مداوم نیازهای مشتریان و تنظیم کننده ها را برآورده می کند.
استاندارد EN ISO 13485 یک استاندارد موازی است که در اتحادیه اروپا به منظور ایجاد یک QMS در صنعت تجهیزات پزشکی برای استفاده در اتحادیه اروپا صادر شده است. الزامات این دو استاندارد یکسان است و کل استاندارد ISO 13485:2016 در سند EN ISO 13485:2016 گنجانده شده است.
با این حال، نسخه اروپایی استاندارد (EN ISO 13485) همچنین شامل چندین جدول ارزشمند است که الزامات ISO 13485:2016 را با سه دستورالعمل اتحادیه اروپا برای تجهیزات پزشکی (دستورالعمل اتحادیه اروپا 90/385/EEC، دستورالعمل اتحادیه اروپا 93/42/EEC) همسو میکند.
و دستورالعمل اتحادیه اروپا 98/79/EC). این امر به شما کمک می کند تا ببینید که چگونه اجرای استاندارد ISO 13485:2016 به شما کمک می کند تا این دستورالعمل های خاص اتحادیه اروپا را رعایت کنید. با انتشار مقررات تجهیزات پزشکی اتحادیه اروپا (EU MDR) در می 2017، که جایگزین این دستورالعملهای قبلی میشود، انتظار میرود نسخه جدیدی از EN ISO 13485 منتشر شود که همسویی نزدیکتری با MDR اتحادیه اروپا نشان میدهد.
ISO 13485:2016 در مقابل 13485:2012
استاندارد اروپا، EN ISO 13485:2012 تجهیزات پزشکی – سیستم های مدیریت کیفیت – الزامات برای اهداف تنظیمی، پس از تایید CEN در 24 ژانویه 2012 منتشر شده است. این استاندارد جایگزین EN ISO 13485: 2003 می شود، اگرچه متن استاندارد جهانی است.
ISO 13485:2003 بدون تغییر است، فقط پیشگفتار و ضمایم در نسخه اروپایی اصلاح شده است. بنابراین الزامات متفاوتی در ISO 13485:2012 نسبت به ISO 13485:2003 وجود ندارد. برای شناسایی الزامات جدید ISO 13485:2016 در مقابل 13485:2003، در پایان ISO 13485:2016 جدید، در پیوست A جدولی وجود دارد – مقایسه محتوا بین ISO 13485:2003 و ISO 13485:2016، که در آن می توانید تمام الزامات جدید و تمایز بین این دو نسخه را ببینید. برای کسب اطلاعات بیشتر، این مقاله را بخوانید: فهرست اسناد اجباری مورد نیاز ISO 13485:2016 یا دانلود ماتریس رایگان ISO 13485:2016 در مقابل ISO 13485:2003.
تفاوت بین ISO 9001 و ISO 13485 چیست؟
اگرچه ISO 13485:2016 یک استاندارد مستقل است، همانطور که در بالا ذکر شد بر اساس ISO 9001:2008 است. بنابراین، در حالی که ISO 9001 یک استاندارد بین المللی شناخته شده برای هر سازمان در هر صنعتی است، استاندارد ISO 13485 شامل الزامات اضافی است که مخصوص شرکت هایی است که دستگاه های پزشکی ISO را تولید می کنند. برای آشنایی بیشتر با نحوه مقایسه این دو استاندارد، این مقاله را بخوانید: شباهت ها و تفاوت های ISO 9001:2015 و ISO 13485:2016.
آیا ایزو 13485 اجباری است؟
پاسخ کوتاه این است که نه، ISO 13485 اجباری نیست. شما می توانید یک QMS متناسب با نیازهای سازمان خود ایجاد کنید، تا زمانی که فرآیندهای QMS الزامات قانونی و مقرراتی را برای دستگاه های پزشکی که در آن قصد تولید و فروش آنها را دارید برآورده می کند.
حتی اگر ISO 13485 برای انطباق با MDR اتحادیه اروپا مورد نیاز نیست، مقررات MDR اتحادیه اروپا مستلزم داشتن یک QMS است، و استاندارد ISO 13485:2016 تنها استاندارد QMS است که در لیست استانداردهای هماهنگ اتحادیه اروپا فهرست شده است، بنابراین اکثر شرکت ها این کار را انجام خواهند داد.
از الزامات ISO 13485 برای پیاده سازی QMS خود استفاده کنید. ارجاع به ISO 13485 در فهرست استانداردهای هماهنگ اتحادیه اروپا نشان می دهد که اتحادیه اروپا درک می کند که با اجرای الزامات ISO 13485، تمام الزامات MDR QMS اتحادیه اروپا برآورده می شود. اینجا بیشتر بیاموزید: ISO 13485 چگونه می تواند به انطباق با MDR کمک کند؟ با استفاده از الزامات ISO 13485 برای ایجاد QMS خود، می توانید اطمینان حاصل کنید که سیستمی در سطح جهانی برای رفع نیازهای مشتریان و قانونگذاران برای دستگاه های پزشکی خود دارید.
ISO 13485 برای برآورده کردن یک الزام قانونی بیش از حداقل حداقل را در اختیار شما قرار می دهد. این یک سیستم کامل را ارائه می دهد که به شما کمک می کند تا فرآیندهای کیفیت خود را بهتر کنید.